
近日,對于疫情進(jìn)展普遍關(guān)注的中國公眾開(kāi)始注意起博瑞生物醫藥(蘇州)股份有限公司(以下簡(jiǎn)稱(chēng)“博瑞醫藥”)這家公司,博瑞醫藥瞬間處于風(fēng)口浪尖之上。今天,筆者暫時(shí)撇開(kāi)瑞德西韋的仿制事件,匯總信息、梳理數據,為各位介紹蘇州博瑞醫藥的業(yè)務(wù)拓展和布局情況。
第一部分:蘇州博瑞醫藥基本情況和上市情況
博瑞生物醫藥(蘇州)股份有限公司,是研發(fā)驅動(dòng)型的高科技制藥公司,致力于研發(fā)及生產(chǎn)原創(chuàng )性新藥和高端仿制藥。這是蘇州博瑞醫藥官網(wǎng)介紹的第一句話(huà)。從后面搜集的信息和數據看,這句話(huà)是蘇州博瑞醫藥對自己的準確定位。
博瑞醫藥在2001年成立,但是成立之后的2001-2005年這段時(shí)間,業(yè)務(wù)處于停滯期。在2006年,蘇州博瑞醫藥開(kāi)發(fā)出擁有自主產(chǎn)權的恩替卡韋合成工藝,這是蘇州博瑞醫藥成立以后的第一個(gè)較大的業(yè)務(wù)進(jìn)展。但是在蘇州博瑞醫藥內部,一直在積累和準備。在2010年,蘇州博瑞醫藥成立全資子公司信泰制藥。到2013年,全資子公司信泰制藥完全建成投產(chǎn),蘇州博瑞在當年通過(guò)美國FDA cGMP認證,這是蘇州博瑞醫藥業(yè)務(wù)全面開(kāi)展的一個(gè)關(guān)鍵節點(diǎn)。2015年,蘇州博瑞醫藥完成股份制改造,并且于當年,實(shí)現信泰制藥和博瑞泰興雙雙通過(guò)國內新版GMP認證;應該說(shuō),這個(gè)時(shí)期博瑞醫藥是從研發(fā)企業(yè)向規范制藥集團轉型的關(guān)鍵階段。
隨后,博瑞醫藥進(jìn)入快速發(fā)展期,在2016年,國際化繼續取得優(yōu)秀成績(jì):當年首次通過(guò)歐盟GMP檢查,而且再次通過(guò)FDA的cGMP認證。 在2017年,蘇州博瑞醫藥在國際市場(chǎng)表現繼續搶眼:顯示以"零缺陷" 通過(guò)美國FDA檢查; 然后,實(shí)現卡泊芬凈注射劑在歐洲上市; 并且在2017年,實(shí)現首次通過(guò)韓國KFDA官方認證,并且首次通過(guò)日本PMDA官方認證。
在隨后的2018年和2019年,蘇州博瑞醫藥開(kāi)始受到媒體和投資資本的高度關(guān)注。不僅獲得資本的青睞,而且前期布局產(chǎn)品大部分開(kāi)始進(jìn)入商業(yè)化階段,開(kāi)始為公司提供豐富回報。目前,蘇州博瑞大部分收益來(lái)自規范市場(chǎng),出口業(yè)務(wù)占據公司主要業(yè)務(wù)部分。
經(jīng)過(guò)前期充分準備,在2019年11月8日,博瑞生物醫藥(蘇州)股份有限公司(以下簡(jiǎn)稱(chēng)"博瑞醫藥")于上海證券交易所科創(chuàng )板正式掛牌上市,股票簡(jiǎn)稱(chēng)"博瑞醫藥",股票代碼為688166 ,本次發(fā)行價(jià)格為12.71元/股,發(fā)行數量為4100萬(wàn)股,募集資金總額約5.2億元。博瑞醫藥由此登陸資本市場(chǎng),開(kāi)啟新的發(fā)展篇章。
第二部分:蘇州博瑞醫藥在國內市場(chǎng)注冊情況
根據NMPA數據庫和丁香園insight數據庫,核實(shí)蘇州博瑞醫藥獲批產(chǎn)品情況、目前在申報情況和臨床試驗進(jìn)展如下。
2.1-蘇州博瑞國內獲得批準情況
根據丁香園insight數據,獲得批準情況參見(jiàn)下表:
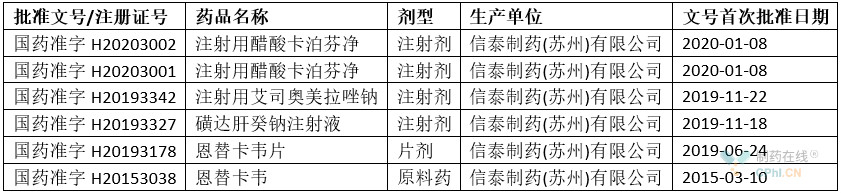
解析:從上面表格可以看出,蘇州博瑞醫藥在中國大陸地區持有產(chǎn)品批文都是由下屬子公司蘇州信泰制藥持有,共有6個(gè)。這些產(chǎn)品包括原料藥、口服固體制劑、注射劑。對于恩替卡韋產(chǎn)品,蘇州博瑞既有原料藥,還有制劑,產(chǎn)品產(chǎn)業(yè)鏈比較完整。
另外,通過(guò)核實(shí),可以確認蘇州博瑞的恩替卡韋片已經(jīng)被列入中國上市藥品目錄集;也顯示蘇州博瑞產(chǎn)品質(zhì)量得到認可。
2.2-蘇州博瑞國內產(chǎn)品在注冊情況
根據NMPA數據庫和丁香園insight數據庫,核實(shí)信息如下:
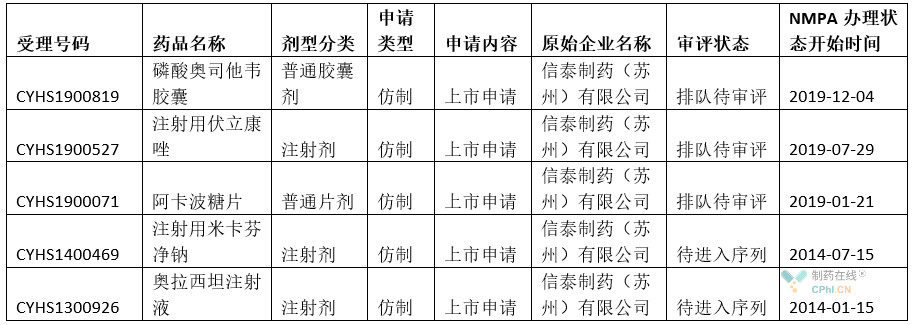
解析:從上面信息看,目前在CDE待審評的注冊項目,蘇州博瑞下屬的信泰制藥共有5項,覆蓋膠囊劑、注射劑、片劑等。其中2014年申報的兩個(gè)項目,估計因為歷史原因,目前處于停滯狀態(tài)。但是2019年申報的項目,應該有較大獲批的可能性。
2.3-蘇州博瑞醫藥臨床試驗進(jìn)展信息
根據丁香園insight數據庫,可以核實(shí)信息如下:
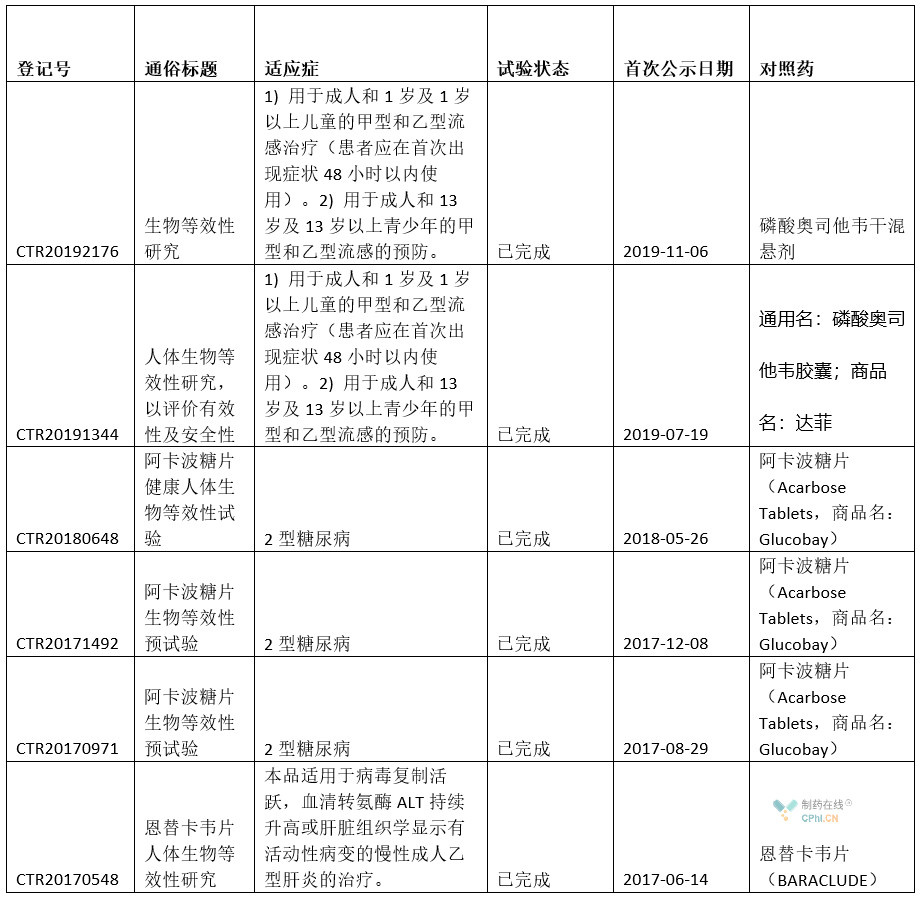
解析:通過(guò)上面信息可以看出,蘇州博瑞在中國境內開(kāi)展的臨床試驗共6項,都屬于仿制藥的BE試驗。試驗都已經(jīng)結束。
第三部分:蘇州博瑞醫藥歐盟注冊情況
蘇州博瑞醫藥不僅在中國市場(chǎng)取得顯著(zhù)成績(jì),在歐盟市場(chǎng)也積極布局和開(kāi)拓。下面介紹蘇州博瑞在歐盟注冊進(jìn)展。
3.1-CEP證書(shū)獲得情況
根據蘇州博瑞官網(wǎng),2018年11月,蘇州博瑞向EDQM遞交恩替卡韋原料藥的CEP證書(shū)申請資料,積極為進(jìn)入歐盟市場(chǎng)開(kāi)展準備。
3.2-歐盟GMP檢查情況匯總
根據蘇州博瑞官網(wǎng),核實(shí)蘇州博瑞歐盟GMP檢查情況如下:

根據2019年的蘇州博瑞醫藥招股書(shū),目前取得是歐盟GMP證書(shū)分別來(lái)自拉脫維亞和德國。
蘇州博瑞不僅在歐盟市場(chǎng)取得認證突破,還在日本和韓國GMP檢查中,順利通過(guò),取得不錯成績(jì)。
第四部分:蘇州博瑞醫藥在美國市場(chǎng)注冊情況
根據蘇州博瑞官網(wǎng)信息,蘇州博瑞在2018年11月,向美國FDA遞交了恩替卡韋片ANDA注冊申請,這也是博瑞醫藥歷史上第一個(gè)ANDA申請。目前此申請還在審評階段。
不僅如此,蘇州博瑞還在美國FDA遞交多份原料藥的DMF文件,目前這些注冊品種有激活品種,也有待審評品種。
第五部分:蘇州博瑞創(chuàng )新藥的進(jìn)展
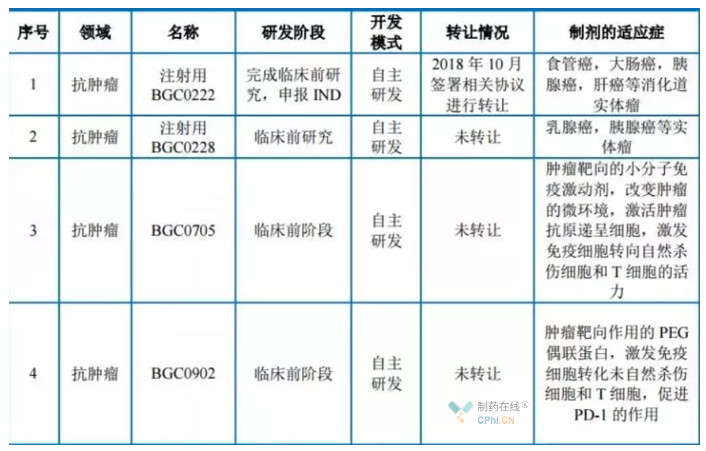
根據2019年蘇州博瑞醫藥的招股書(shū),雖然目前蘇州博瑞醫藥的主要收入來(lái)自高端仿制藥項目。但是,博瑞醫藥依托強大的技術(shù)平臺,也在創(chuàng )新藥領(lǐng)域積極布局和開(kāi)拓。例如,招股書(shū)提到的兩項創(chuàng )新藥項目,分別獲得臨床批件和遞交臨床試驗申請:
經(jīng)過(guò)核實(shí)相關(guān)資料,目前公司在開(kāi)發(fā)的創(chuàng )新藥項目有如下項目:
結語(yǔ)
綜合上述信息,目前蘇州博瑞醫藥業(yè)務(wù)繼續聚焦臨床未被滿(mǎn)足的需求,持續在腫瘤的靶向治療和免疫治療領(lǐng)域以及脂肪肝和糖尿病治療領(lǐng)域繼續發(fā)力。隨著(zhù)博瑞醫藥原料藥項目在歐盟取得突破,制劑項目在FDA注冊有明顯進(jìn)展,估計蘇州博瑞會(huì )在歐美兩個(gè)市場(chǎng)持續獲得更高收益,也會(huì )對企業(yè)自身發(fā)展補充更多能源。
說(shuō)明:本文內容不構成投資建議和推薦信息。
參考文獻
1- NMPA官網(wǎng)信息
2- CDE官網(wǎng)信息
3- FDA官網(wǎng)信息
4- 吉利德官網(wǎng)信息
5- 博瑞醫藥官網(wǎng)信息
6- 博瑞醫藥招股書(shū)資料
作者簡(jiǎn)介:zhulikou431,高級工程師、PDA會(huì )員、ISPE會(huì )員、ECA會(huì )員、PQRI會(huì )員、資深無(wú)菌GMP專(zhuān)家,在無(wú)菌工藝開(kāi)發(fā)和驗證、藥品研發(fā)和注冊、CTD文件撰寫(xiě)和審核、法規審計、國際認證、國際注冊、質(zhì)量體系建設與維護領(lǐng)域,以及無(wú)菌檢驗、環(huán)境監控等領(lǐng)域皆具有較深造詣。近幾年開(kāi)始著(zhù)力關(guān)注制藥宏觀(guān)領(lǐng)域趨勢分析和制藥企業(yè)并購項目的風(fēng)險管理工作。
點(diǎn)擊下圖進(jìn)行CPhI & P-MEC China 2020觀(guān)眾預登記,立省100元觀(guān)展門(mén)票!




合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57