6月5日,諾華的「鹽酸伊普可泮膠囊」被CDE擬納入優(yōu)先審評,用于成人陣發(fā)性睡眠性血紅蛋白尿癥(PNH)患者的治療。
鹽酸伊普可泮(iptacopan,LNP023)是諾華研發(fā)的首 個(gè)靶向補體旁路途徑B因子的口服抑制劑,作用于補體系統C5末端通路的上游,同時(shí)控制血管內溶血和血管外溶血,彌補了抗C5抗體的不足,被開(kāi)發(fā)用于治療多種補體介導疾病,如陣發(fā)性睡眠性血紅蛋白尿癥(PNH)、C3腎小球病(C3G)、IgA腎病(IgAN)、非典型溶血性尿毒癥綜合征(aHUS)、膜性腎病(MN)、狼瘡性腎炎(LN)以及免疫性血小板減少性紫癜(ITP)和冷凝集素病(CAD)等。
2023年5月,諾華宣布評估iptacopan單藥治療未接受過(guò)補體抑制劑(包括抗C5抗體)治療的PNH成人患者療效和安全性的3期臨床試驗達到主要終點(diǎn)。該研究是一項單臂、開(kāi)放標簽、多中心研究,共入組40例平均血紅蛋白(Hb)<10g/dL、乳酸脫氫酶(LDH)>1.5x正常值上限且未接受過(guò)補體抑制劑治療的成人PNH患者。
結果顯示:試驗達到主要研究終點(diǎn),92.2%患者在不輸注紅細胞(RBCT)情況下達到血紅蛋白水平較基線(xiàn)升高≥2g/dl。次要終點(diǎn)也顯示出臨床意義上的改善,如62.8%的患者在RBCT情況下血紅蛋白水平較基線(xiàn)升高≥12g/dl,97%的患者避免輸血。
在國內,iptacopan先后于2022年3月和2023年2月被CDE納入突破性治療品種,分別用于治療 C3腎小球病(C3G)和陣發(fā)性睡眠性血紅蛋白尿癥(PNH)。此次iptacopan被CDE納入優(yōu)先審評,將進(jìn)一步加速其PNH適應癥在國內的獲批上市。
關(guān)于PNH及其治療進(jìn)展
陣發(fā)性睡眠性血紅蛋白尿癥(PNH)是一種罕見(jiàn)的獲得性克隆性造血干細胞疾病,全球發(fā)病率約為1~2/百萬(wàn), 亞洲地區發(fā)病率相較西方高。PNH是由于患者造血干細胞的PIG-A基因突變,使部分或完全血細胞膜糖化磷脂酰肌醇(GPI)錨合成障礙,造成血細胞表面的GPI錨連蛋白(如補體調節蛋白CD55、CD59)缺失,細胞滅活補體能力減弱,從而引起細胞被破壞和發(fā)生溶血等。PNH患者的臨床表現主要為不同程度的發(fā)作性血管內溶血、陣發(fā)性血紅蛋白尿、骨髓造血功能衰竭和靜脈血栓形成。
補體系統是機體固有免疫的組成部分。在補體介導的溶血反應中,補體激活早期階段被稱(chēng)為近端通路。PNH患者的紅細胞因CD55缺乏導致C3裂解增多,C3a和C3b的形成增加,C3b介導的調理作用使紅細胞在脾和肝 臟被吞噬,導致血管外溶血(EVH)。C3a及C3b形成后產(chǎn)生的補體級聯(lián)反應被稱(chēng)為遠端通路。PNH患者的紅細胞因CD59的缺乏使C5b更多的轉化為膜攻擊復合物(MAC),導致紅細胞直接裂解,即血管內溶血(IVH)。
抗C5是公認的PNH標準治療。目前,全球監管機構已批準3款PNH藥物,即Soliris(依庫珠單抗,阿斯利康/Alexion)、Ultomiris(ravulizumab,阿斯利康/Alexion)和Empaveli (pegcetacoplan,Apellis公司),其中僅Soliris在國內獲批上市。
• Soliris是全球首 個(gè)獲批的C5補體抑制劑,通過(guò)選擇性抑制末端補體C5蛋白質(zhì)的激活來(lái)發(fā)揮作用,2007年3月被FDA批準用于治療PNH,隨后又被批準用于治療非典型溶血性尿毒癥綜合征(aHUS)、抗乙酰膽堿受體(AchR)抗體陽(yáng)性的難治性全身型重癥肌無(wú)力(gMG)和抗水通道蛋白-4(AQP4)抗體陽(yáng)性的成年患者的視神經(jīng)脊髓炎癥(NMOSD)。
• Ultomiris是Soliris的升級版,是第一種每8周給藥一次的長(cháng)效C5補體抑制劑,2018年12月被FDA批準用于治療PNH,隨后又被批準用于治療aHUS、gMG和NMOSD。
• Empaveli是FDA批準的首 個(gè)治療PNH的補體C3靶向療法,它是一種合成的環(huán)肽,與聚乙二醇聚合物偶聯(lián),特異性結合于C3和C3b。2021年5月,Empaveli 被FDA批準用于治療未經(jīng)治療的成人PNH患者,以及既往接受過(guò)補體C5抑制劑Soliris (依庫珠單抗)和Ultomiris (ravulizumab)治療的PNH患者。
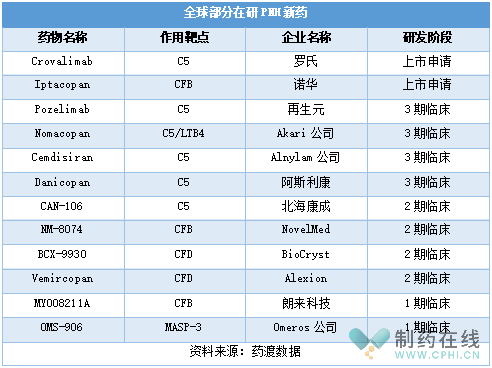
此外,目前全球還有多款在研PNH新藥,詳見(jiàn)下表。作用靶點(diǎn)上,除了C5,在研PNH新藥靶點(diǎn)還涉及CFB、CFD等。藥物類(lèi)型上,除了單抗和環(huán)肽,還包括RNAi藥物,如Cemdisiran。
研發(fā)進(jìn)度上,羅氏的Crovalimab和諾華的Iptacopan進(jìn)展較快。2022年8月Crovalimab治療PNH的上市申請獲CDE受理,且被納入優(yōu)先審評。Crovalimab是羅氏通過(guò)連續單克隆抗體回收技術(shù)(Smart-Ig)工程化改造自主研發(fā)的的新一代C5抑制劑,可以阻斷補體C5裂解為C5a和C5b。
與已批準的C5抑制劑相比,Crovalimab高度可溶,提供持續完整的末端補體途徑抑制,允許小劑量皮下注射(1-4 mL),可每月一次給藥,同時(shí)作為皮下注射劑,患者可以在家自行給藥,大大提升了依從性;其特異性靶向表位,能覆蓋到更多臨床情形的PNH患者,并表現出良好的耐受性和可接受的安全性。
此外,目前全球還有多款在研PNH新藥進(jìn)入后期臨床,如Pozelimab、Nomacopan等。預計不久的將來(lái),PNH領(lǐng)域將迎來(lái)更多治療選擇。



合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57