藥智數據精選上周(8月19日~8月25日)新藥研發(fā)領(lǐng)域最新動(dòng)態(tài),包括新藥研發(fā)進(jìn)展、重磅藥品交易等信息,一文速覽。
資料來(lái)源:藥智數據企業(yè)版——全球藥物分析系統數據庫、各企業(yè)官網(wǎng)更多全球新藥最新進(jìn)展及詳細信息
神州細胞:
三特異性抗體
近日,據CDE官網(wǎng)顯示,神州細胞工程有限公司(以下簡(jiǎn)稱(chēng)“神州細胞”)1類(lèi)新藥SCTB41注射液獲得臨床試驗默示許可,適應癥為晚期惡性實(shí)體瘤。

圖片來(lái)源:CDE官網(wǎng)
神州細胞專(zhuān)注于創(chuàng )新生物藥和疫苗開(kāi)發(fā),目前已建立多樣化且豐富的在研管線(xiàn),包括14價(jià)HPV疫苗、CD20單抗、IL-17單抗、CD20×CD3雙抗等,適應癥涵蓋非霍奇金淋巴瘤等多種實(shí)體瘤和血液腫瘤,以及自身免疫性疾病等。
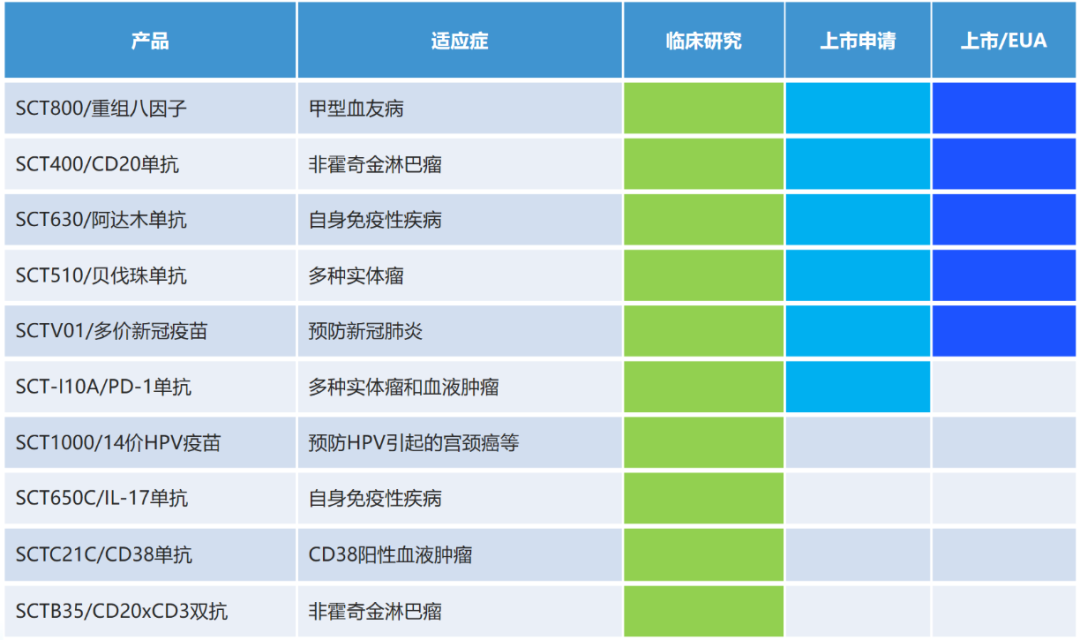
圖片來(lái)源:神州細胞
SCTB41注射液是神州細胞以差異化競爭優(yōu)勢為目標自主研發(fā)的一款三特異性抗體注射液,可針對多種實(shí)體瘤免疫治療,目前尚未公開(kāi)具體靶點(diǎn)。SCTB41注射液的臨床試驗申請獲得CDE批準后,神州細胞或將對其開(kāi)啟進(jìn)一步研究。02
其他新藥研發(fā)進(jìn)展
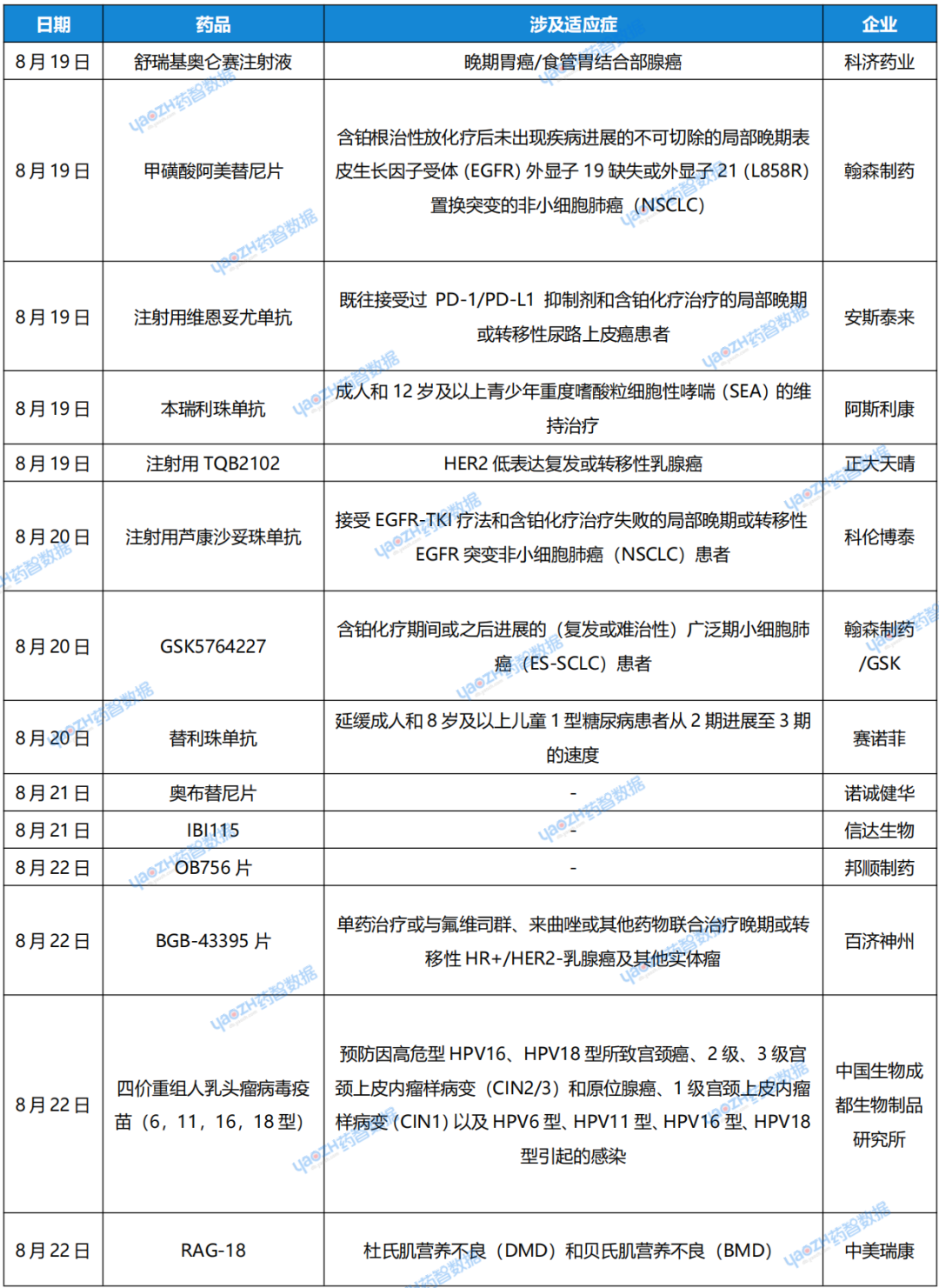
1.科濟藥業(yè)「舒瑞基奧侖賽注射液」完成2期臨床全部受試者入組
8月19日,科濟藥業(yè)宣布其CAR-T細胞產(chǎn)品舒瑞基奧侖賽注射液(代號:CT041)在中國進(jìn)行的針對晚期胃癌/食管胃結合部腺癌的確證性2期臨床試驗完成全部受試者入組。該研究是一項在中國進(jìn)行的開(kāi)放標簽、多中心、隨機對照臨床試驗,旨在評估舒瑞基奧侖賽注射液治療Claudin18.2表達陽(yáng)性、既往接受過(guò)至少2種治療失敗的晚期胃癌/食管胃結合部腺癌的有效性和安全性。
2.翰森制藥「甲磺酸阿美替尼片」新適應癥申報上市
8月19日,翰森制藥宣布其自主研發(fā)的1類(lèi)新藥甲磺酸阿美替尼片新適應癥上市申請獲CDE受理,用于含鉑根治性放化療后未出現疾病進(jìn)展的不可切除的局部晚期表皮生長(cháng)因子受體(EGFR)外顯子19缺失或外顯子21(L858R)置換突變的非小細胞肺癌(NSCLC)患者治療,這是阿美替尼片在中國提交的第四個(gè)適應癥上市申請。
3.安斯泰來(lái)「注射用維恩妥尤單抗」在華獲批上市
8月19日,據NMPA官網(wǎng)顯示,安斯泰來(lái)遞交的 Nectin-4 靶向 ADC 注射用維恩妥尤單抗上市申請已獲得批準,用于治療既往接受過(guò) PD-1/PD-L1 抑制劑和含鉑化療治療的局部晚期或轉移性尿路上皮癌患者。據了解,維恩妥尤單抗是全球首 個(gè)獲批上市的Nectin-4 ADC,也是首 個(gè)在國內獲批的Nectin-4靶向ADC。
4.阿斯利康「本瑞利珠單抗」在華獲批上市
8月19日,據NMPA官網(wǎng)顯示,阿斯利康的本瑞利珠單抗(benralizumab)注射液獲批上市,用于成人和12歲及以上青少年重度嗜酸粒細胞性哮喘(SEA)的維持治療。2023年6月,benralizumab在國內首次申報上市(受理號:JXSS2300050);今年5月14日,該藥物的新適應癥上市申請又獲得CDE受理(受理號:JXSS2400041)。Benralizumab是一款I(lǐng)L-5Rα單克隆抗體,可直接與嗜酸性粒細胞上的IL-5受體α結合,吸引自然殺傷細胞通過(guò)細胞凋亡誘導患者血液和組織嗜酸性粒細胞快速且幾乎完全耗盡。
5.正大天晴「注射用TQB2102」啟動(dòng)III期臨床
8月19日,據藥物臨床試驗登記與信息公示平臺顯示,正大天晴開(kāi)發(fā)的HER2雙抗ADC“注射用TQB2102”啟動(dòng)了首 個(gè)III期臨床試驗,成為第2款進(jìn)入III期階段的HER2雙抗ADC。TQB2102是正大天晴自主研發(fā)的一種靶向HER2兩個(gè)非重疊表位ECD2及ECD4的ADC,由人源化HER2 IgG1雙抗通過(guò)連接子與拓撲異構酶I抑制劑偶聯(lián)而成。TQB2102靜注入血后,抗體部分與HER2陽(yáng)性腫瘤細胞表面ECD2、ECD4結合,ADC復合物經(jīng)細胞內吞并轉運到溶酶體,連接子經(jīng)酶切后釋放出小分子藥物,導致DNA損傷和細胞死亡。
6.科倫博泰「注射用蘆康沙妥珠單抗」新適應癥申報上市
8月20日,據CDE官網(wǎng)顯示,科倫博泰注射用蘆康沙妥珠單抗遞交新藥上市申請并獲得受理。根據科倫博泰公告,本次申請上市的適應癥為:治療接受EGFR-TKI療法和含鉑化療治療失敗的局部晚期或轉移性EGFR突變非小細胞肺癌(NSCLC)患者。日前,該適應癥已經(jīng)獲CDE擬納入優(yōu)先審評。此外,這也是蘆康沙妥珠單抗獲CDE受理的第二項新藥上市申請。
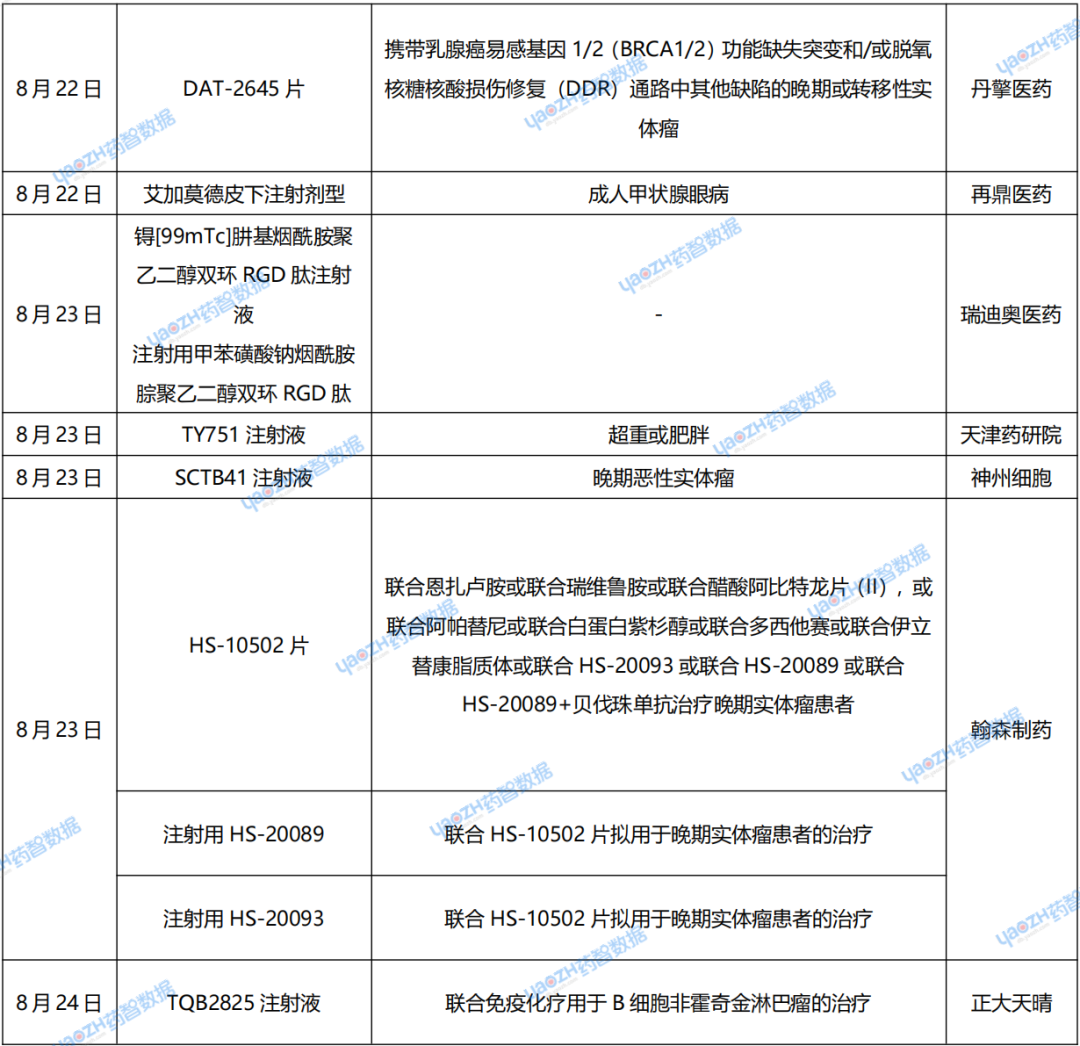
全球藥品交易動(dòng)態(tài)
1.普眾發(fā)現「TF ADC」10億美元授權出海
8月20日,普眾發(fā)現宣布與Adcendo ApS(以下簡(jiǎn)稱(chēng)“Adcendo”)達成合作。雙方就代號為ADCE-T02(普眾發(fā)現研發(fā)代號AMT-754)的一種新型、高度差異化的靶向組織因子(Anti-TF)的抗體偶聯(lián)藥物(ADC)達成許可協(xié)議,Adcendo將獲得在大中華區以外的全球獨家開(kāi)發(fā)和商業(yè)化權利,而普眾發(fā)現將保留在大中華地區(包括中國大陸、香港特別行政區、澳門(mén)特別行政區及臺灣地區)的開(kāi)發(fā)和商業(yè)化權利。根據協(xié)議的財務(wù)條款,普眾發(fā)現將獲得數千萬(wàn)美元的首付款,并在達成后續開(kāi)發(fā)、監管及商業(yè)里程碑時(shí),將收取總計超過(guò)10億美元的總里程碑付款,以及基于全球(不包括大中華地區)凈銷(xiāo)售額的個(gè)位數至低兩位數百分比的銷(xiāo)售提成。
2.科倫藥業(yè)與默沙東合作的SKB264/MK2870項目取得新進(jìn)展
8月20日,科倫藥業(yè)發(fā)布公告,披露了子公司科倫博泰與默沙東的合作進(jìn)展,涉及兩家企業(yè)合作的TROP2靶向ADC藥物SKB264/MK2870項目(現稱(chēng)“Sac-TMT”項目)。截至2024年6月30日,默沙東已啟動(dòng)十項Sac-TMT作為單一療法或聯(lián)合帕博利珠單抗或其他藥物用于多種適應癥的全球3期臨床研究。




合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57