
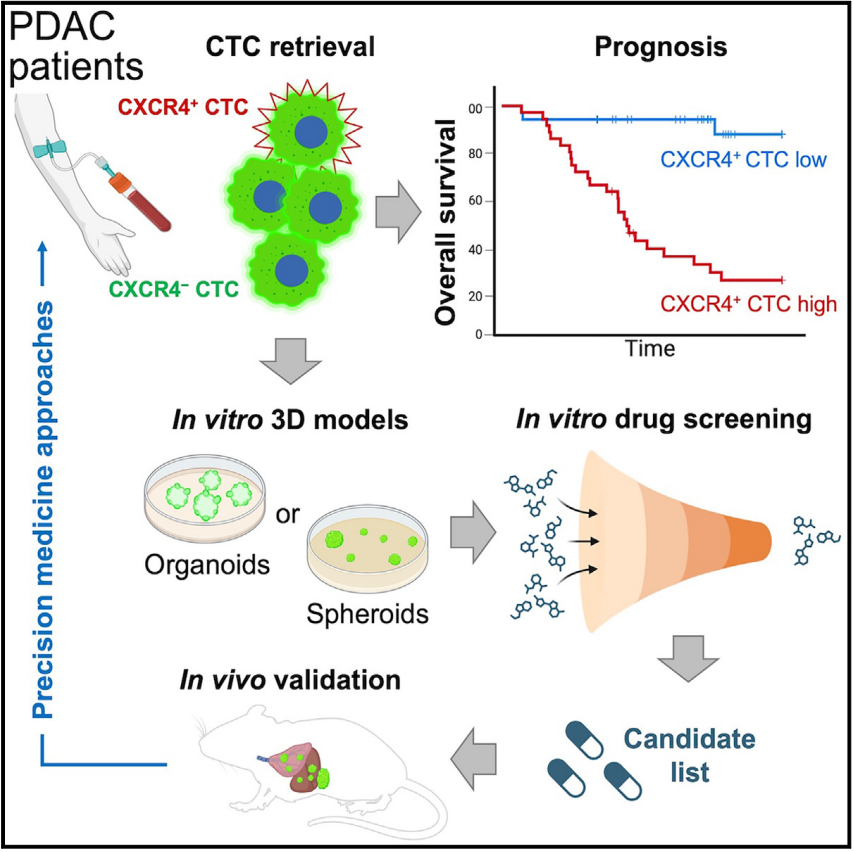
論文鏈接:








合作咨詢
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2025 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57