3月11日晚間,傳奇生物公布了2023年業(yè)績(jì):2023年實(shí)現總收入2.85億美元,同比增加143.7%。
西達基奧侖賽大賣(mài)5億元
據財報顯示,西達基奧侖賽2023年第四季度和全年的凈貿易銷(xiāo)售額分別約為1.59億美元和5億美元。
西達基奧侖賽(英文通用名Ciltacabtagene Autoleucel,簡(jiǎn)稱(chēng)Cilta-cel)是一種靶向B細胞成熟抗原(BCMA)的嵌合抗原受體T細胞(CAR-T)療法,使用嵌合抗原受體(CAR)的轉基因對患者自身的T細胞進(jìn)行修飾,以識別和消除表達BCMA的細胞。BCMA主要表達于惡性多發(fā)性骨髓瘤B細胞譜系、晚期B細胞和漿細胞的表面。
西達基奧侖賽的CAR蛋白具有兩種靶向BCMA單域抗體,對表達BCMA的細胞具有高親和力,在與表達BCMA的細胞結合后,CAR可促進(jìn)T細胞活化、擴增,繼而清除靶細胞。
2017年12月,楊森與傳奇生物簽訂了全球獨家許可和合作協(xié)議,以開(kāi)發(fā)和商業(yè)化西達基奧侖賽。
2019年12月和2020年8月西達基奧侖賽分別獲美國和中國突破性療法認定。成為中國首 個(gè)獲得“突破性療法”的CAR-T療法。
2022年西達基奧侖賽獲得美國食品藥品監督管理局(FDA)、日本厚生勞動(dòng)省(MHLW)批準上市,并獲得歐盟委員會(huì )(EC)附條件上市許可,有望解決多發(fā)性骨髓瘤治療的世界 級難題。
2022年底,國家藥品監督管理局正式受理西達基奧侖賽的新藥上市申請(NDA),并于2023年1月納入優(yōu)先審評程序。
另?yè)骘@示,CHMP建議將西達基奧侖賽適應癥范圍擴大至復發(fā)和來(lái)那度胺耐藥的多發(fā)性骨髓瘤成人患者的前線(xiàn)治療。
FDA ODAC將于3月15日召開(kāi)會(huì )議,審查CARTITUDE-4研究的數據,該研究支持將cilta-cel用于復發(fā)和來(lái)那度胺耐藥的多發(fā)性骨髓瘤成人患者的前線(xiàn)治療。
多種先進(jìn)細胞療法開(kāi)發(fā)中
傳奇生物成立于2014年,是一家集腫瘤免疫細胞療法研發(fā)、臨床、生產(chǎn)及商業(yè)化開(kāi)發(fā)于一體的早期細胞治療公司。
目前多種先進(jìn)細胞療法正在開(kāi)發(fā)中,包括自體和異體嵌合抗原受體 T 細胞、γδ T 細胞和自然殺傷(NK)細胞免疫療法。
傳奇生物研發(fā)管線(xiàn)
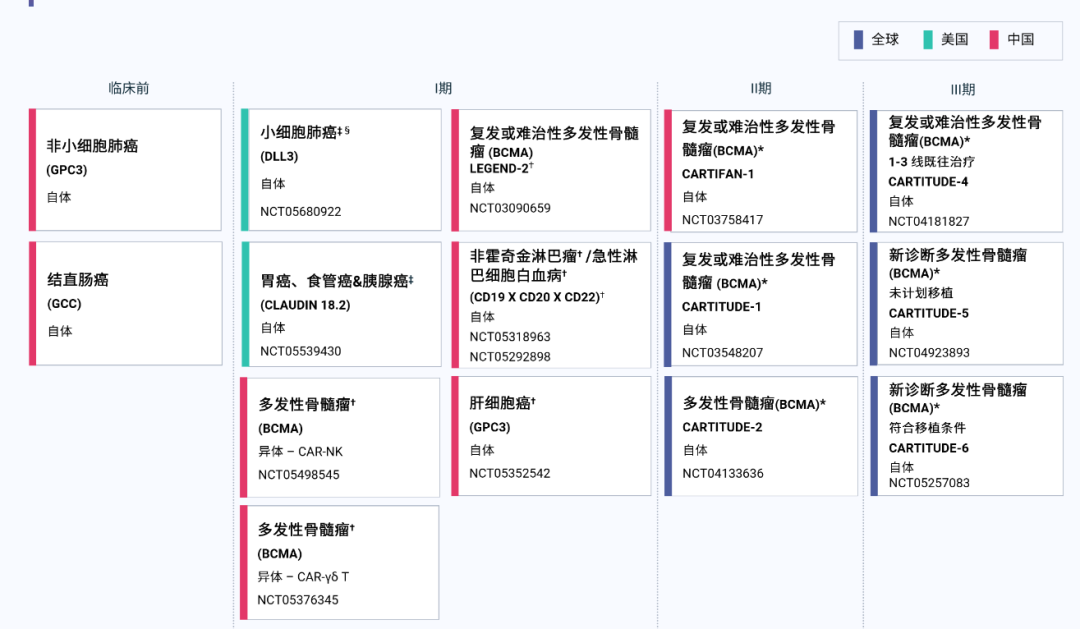
圖片來(lái)源:傳奇生物企業(yè)公告
小 結
2023年為西達基奧侖在商業(yè)化的第一年,其實(shí)現了5億美元的全球銷(xiāo)售額。西達基奧侖在強生、適應癥擴大范圍及未被滿(mǎn)足的臨床需求加持下,仍處在高速增長(cháng)階段,有望快速突破10億美元躋身重磅炸 彈系列,成為國產(chǎn)創(chuàng )新藥出海的一個(gè)標桿。








合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57