2023年10月,FDA批準多款新藥,包括新分子實(shí)體、新適應癥及新制劑等,預計很快就會(huì )上市,造福廣大患者。以下為上月批準新藥的情況匯總,以期為相關(guān)藥品研發(fā)企業(yè)提供參考。
01
生產(chǎn)廠(chǎng)家:諾華
申請類(lèi)型:新適應癥
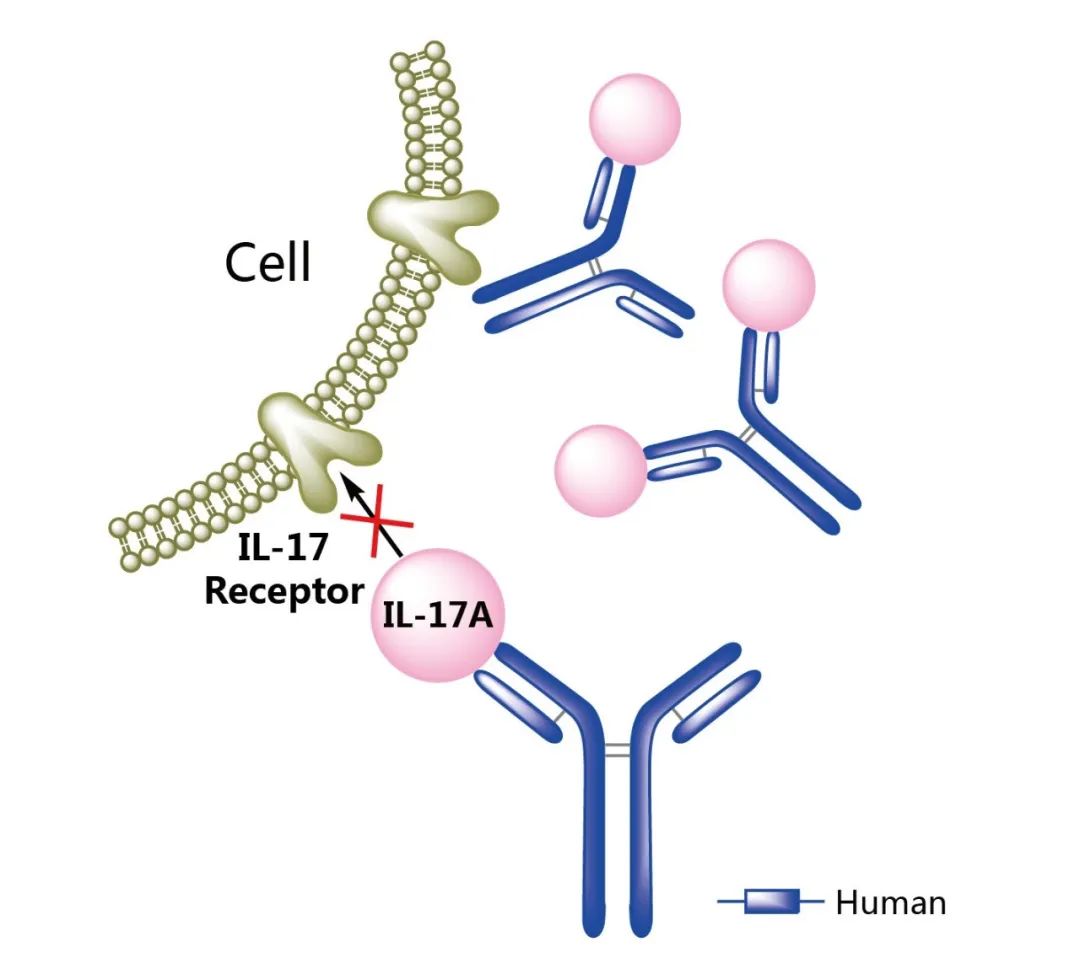
Cosentyx(secukinumab,司庫奇尤單抗)是第一個(gè)也是唯一一個(gè)特異性靶向和阻斷白細胞介素-17A(IL-17A)的全人類(lèi)生物制劑。此前,已批準治療銀屑病關(guān)節炎、中度至重度斑塊狀銀屑病、強直性脊柱炎和非影像學(xué)中軸型脊柱關(guān)節炎。
2023年10月6日,FDA批準Cosentyx用于治療成人中度至重度化膿性汗腺炎(HS),批準的劑量為300mg。此次批準是基于臨床三期項目SUNSHINE和SUNRISE的分析,其中每?jì)芍芑蛎克闹芊肅osentyx 300mg的患者,化膿性汗腺炎臨床反應(HisCR50)緩解的比例高于安慰劑。
02
VELSIPITY
生產(chǎn)廠(chǎng)家:Pfizer
申請類(lèi)型:新分子
VELSIPITY(etrasimod,伊曲莫德)是一種每日一次的口服鞘氨醇1-磷酸(S1P) 受體調節劑,可選擇性地與S1P受體亞型1、4和5結合。
2023年10月12日FDA批準用于治療成人中度至重度活動(dòng)性潰瘍性結腸炎(UC)。VELSIPITY的批準推薦劑量為2毫克。FDA的批準是基于ELEVATE UC的3期臨床的結果,該項目評估了VELSIPITY 2mg每日一次劑量,對既往至少一種常規生物制劑或Janus激酶(JAK)抑制劑治療失敗或不耐受的UC患者臨床緩解的安全性和有效性。研究均達到所有主要和關(guān)鍵的次要療效終點(diǎn),表明其良好的安全性與有效性。
03
XPHOZAH
生產(chǎn)廠(chǎng)家:ARDELYX INC
申請類(lèi)型:新適應癥
2023年10月17日,美國FDA批準Xphozah(tenapanor)用于降低患有慢性腎臟病(CKD)成人透析患者的血清磷水平,作為對磷酸鹽結合劑應答不足或對任何劑量的磷酸鹽結合劑治療不耐受的患者的附加治療。磷含量高的慢性腎臟病患者傳統上使用磷酸鹽結合劑進(jìn)行治療。這種結合劑可以在消化過(guò)程中從食物中吸收磷,使用劑量較大。Xphozah是第一個(gè)也是目前唯一一個(gè)磷酸鹽吸收抑制劑,它是一種單片劑,每天服用兩次。
Xphozah的批準基于三項3期臨床試驗,分別為T(mén)EN-02-201[NCT02675998]、TEN-02-301[NCT03427125]和TEN-02-202[NCT03824587]。這些試驗的重點(diǎn)是評估Xphozah降低透析成人慢性腎臟病患者血清磷的安全性和有效性,所有試驗都成功達到了主要和關(guān)鍵的次要終點(diǎn)。此前,tenapanor已于2019年獲得FDA批準用于治療成人便秘型腸易激綜合征,商品名為Ibsrela。
04
COMBOGESIC IV
生產(chǎn)廠(chǎng)家:AFT PHARMS LTD
申請類(lèi)型:新組合物
2023年10月17日,FDA批準Maxgesic?IV,用于緩解輕度至中度疼痛,并作為成人阿 片類(lèi)止痛藥的輔助藥物,用于治療中度至重度疼痛。Maxigestic?IV是1000mg撲熱息痛和300mg布洛芬溶液的獨特組合,用于術(shù)后輸液。將以Combogesic?IV的商品名在美國上市。
此次批準是基于III期臨床階段項目的積極數據,在該項目中,Maxgesic?IV證明與對乙酰氨基酚IV、布洛芬IV以及安慰劑相比,它具有良好的耐受性,起效更快,疼痛緩解率更高。Maxigestic?IV的卓越鎮痛效果,也得到了包括阿 片類(lèi)藥物使用率的降低等一系列次要終點(diǎn)的支持。
05
ZILBRYSQ
生產(chǎn)廠(chǎng)家:UCB INC
申請類(lèi)型:新分子
2023年10月17日, FDA批準zilucoplan(商品名:Zilbrysq)的新藥上市申請,用于治療乙酰膽堿受體(AChR)抗體陽(yáng)性的全身型重癥肌無(wú)力(gMG)成年患者。該藥是首 款獲FDA批準用于gMG的補體C5抑制劑,每日自行皮下給藥一次。zilucoplan的雙重作用機制,可阻止末端補體途徑的激活以及膜攻擊復合物(MAC)的下游組裝和活性,從而阻止其損壞突觸后膜,破壞離子通道傳導和損害神經(jīng)肌肉信號傳遞。
此次獲批主要基于一項隨機雙盲、安慰劑對照的多中心III期RAISE研究結果。與安慰劑相比,第12周時(shí)zilucoplan組患者重癥肌無(wú)力-日常生活活動(dòng)能力量表(MG-ADL)總評分較基線(xiàn)有統計學(xué)意義上的改善;zilucoplan組的重癥肌無(wú)力定量評分(QMG)、重癥肌無(wú)力復合評分(MGC)和改良的15項重癥肌無(wú)力生活質(zhì)量(MG-QoL15r)評分較基線(xiàn)均有顯著(zhù)改善。
06
QLOSI
生產(chǎn)廠(chǎng)家:ORASIS PHARMACEUTICALS, LTD
申請類(lèi)型:新制劑
2023年10月17日,美國FDA批準Qlosi(0.4%鹽酸毛果蕓香堿滴眼液)上市,用于治療成人老花眼。Qlosi是一種不含防腐劑的低劑量毛果蕓香堿和多面載體構成的滴眼液。主要作用機制是收縮瞳孔,從而增強景深,改善近視力和中距視力。Qlosi可每日使用,或根據需要使用,每日最多兩次。
此次批準是基于III期臨床試驗NEAR-1和NEAR-2的結果。兩項試驗均在第8天達到其主要和關(guān)鍵次要終點(diǎn),顯著(zhù)提高了視力表多讀三行的患者比例。接受第一劑治療后一小時(shí)內40%的患者多讀三行,這一比例在接受第二劑治療后達到50%。受試者最早在接受治療20分鐘后,就可獲得視力改善,并且療效可持續長(cháng)達8個(gè)小時(shí)。
07
BIMZELX
生產(chǎn)廠(chǎng)家:UCB INC
申請類(lèi)型:新適應癥
2023年10月17日, FDA批準BIMZELX?(bimekizumab-bkzx)用于治療中度至重度斑塊性銀屑病的成人患者。Bimekizumab是首 個(gè)也是唯一一個(gè)被批準用于治療成人中重度斑塊型銀屑病的IL-17A和IL-17F抑制劑,作用機制為選擇性抑制驅動(dòng)炎癥過(guò)程的關(guān)鍵細胞因子——白細胞介素17A (IL-17A)和白細胞介素17F (IL-17F)。
Bimekizumab的批準得到了三個(gè)III期、多中心、隨機、安慰劑和/或活性對照試驗的數據支持,這些試驗評估了bimekizumab在1480名中度至重度斑塊性銀屑病成人患者中的療效和安全性。在第16周,85%-91%接受BIMZELX治療的患者獲得了清晰或幾乎清晰的皮膚,59-68%達到了完全清除的目標。
08
ZITUVIO
生產(chǎn)廠(chǎng)家:ZYDUS WORLDWIDE DMCC
申請類(lèi)型:活性成分新鹽型
2023年10月18日,FDA批準Zituvio(sitagliptin)上市,作為飲食和運動(dòng)的輔助藥物,以改善成人2型糖尿病的血糖控制。Zituvio含有活性成分sitagliptin,一種二肽基肽酶-4(DPP-4)抑制劑。腸促生長(cháng)素,包括胰高血糖素樣肽-1(GLP-1)和葡萄糖依賴(lài)性促胰島素多肽(GIP),全天由腸道釋放,并且水平會(huì )隨著(zhù)用餐而升高。sitagliptin通過(guò)減緩腸促生長(cháng)素的失活,而在2型糖尿病患者中發(fā)揮作用。sitagliptin于2006年首次以Januvia(磷酸西格列汀)的商品名獲得批準。Zituvio為含有游離堿形式的sitagliptin。
09
CABTREO
生產(chǎn)廠(chǎng)家:BAUSCH HEALTH US, LLC
申請類(lèi)型:新組合物
2023年10月20日,FDA批準Cabtreo(磷酸克林霉素、阿達帕林和過(guò)氧化苯甲酰)外用凝膠1.2%/0.15%/3.1%的新藥申請,適用于十二歲及以上尋常痤瘡患者的局部治療。該藥結合抗生素、類(lèi)維生素A和抗菌劑三種作用機制,旨在治療與中度至重度痤瘡相關(guān)的炎癥、細菌和毛囊角化過(guò)度。是首 個(gè)也是當前唯一一個(gè)經(jīng)FDA批準的固定劑量、三聯(lián)組合的痤瘡局部治療藥物。
兩項多中心、隨機、雙盲III期臨床試驗(試驗1和試驗2,分別為NCT04214639和2NCT04214652)評估表明,在試驗1中,接受Cabtreo治療的患者獲得皮膚癥狀清除或幾乎清除的比例(49.6%),顯著(zhù)高于接受賦形劑凝膠治療的患者(24.9%)。在試驗2中,接受Cabtreo治療成功的患者(50.5%)相對于賦形劑凝膠組(20.5%),具有與試驗1一致的顯著(zhù)治療成功率。
10
ZYMFENTRA
生產(chǎn)廠(chǎng)家:CELLTRION
申請類(lèi)型:新制劑
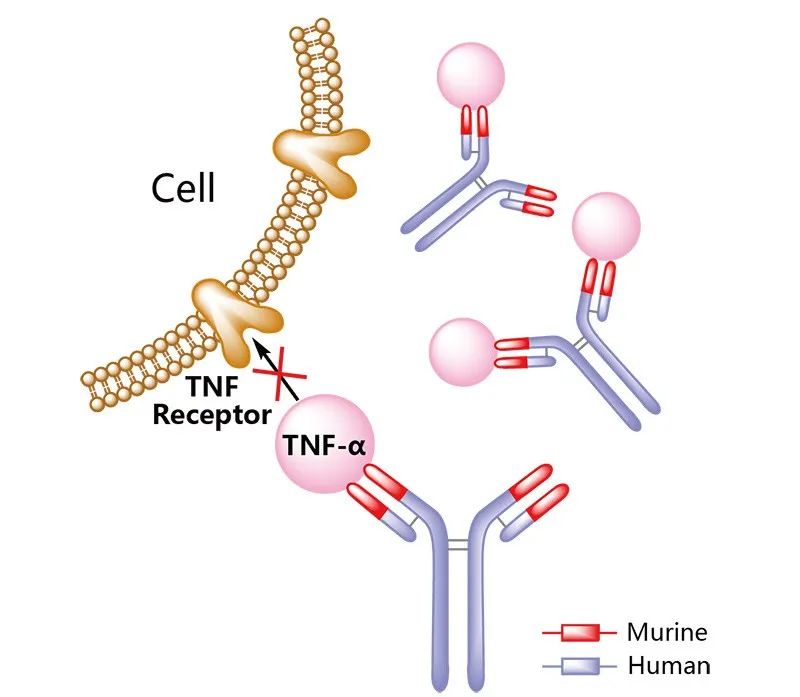
Infliximab是一種抗腫瘤壞死因子α(tumor necrosis factor alpha,TNFα)的單克隆抗體。2023年10月20日,FDA批準Zymfentra(infliximab)用于中重度活動(dòng)性潰瘍性結腸炎(UC)和克羅恩病(CD)成人患者,在接受靜脈給予infliximab單抗治療后的維持治療。Zymfentra是獲FDA批準用以治療炎癥性腸病(IBD)的首 個(gè)infliximab皮下制劑,可提供血清中穩定升高的infliximab單抗水平。
一項隨機、安慰劑對照、雙盲、III期研究LIBERTY-UC表明第54周時(shí),ZYMFENTRA的臨床緩解率 (43.2%) 顯著(zhù)高于安慰劑 (20.8%)。一項隨機、安慰劑對照、雙盲III期研究LIBERTY-CD表明第54周時(shí),ZYMFENTRA組的臨床緩解率高于安慰劑組(分別為62.3%和32.1%,P<0.0001)。與此同時(shí),ZYMFENTRA組在第54周時(shí)的內鏡緩解率也高于安慰劑組(分別為51.1%和17.9%,P<0.0001)。ZYMFENTRA和安慰劑組在維持階段的安全性總體上相當。
11
AGAMREE
生產(chǎn)廠(chǎng)家:SANTHERA PHARMA
申請類(lèi)型:新分子
2023年10月26日,FDA批準Agamree(vamorolone)上市,用于治療2歲及以上患者的杜氏肌營(yíng)養不良癥(DMD)。Agamree以40mg/mL口服混懸液形式提供,通過(guò)糖皮質(zhì)激素受體發(fā)揮抗炎和免疫抑制作用。此次批準基于隨機、雙盲、安慰劑和活性對照的2b期VISION-DMD研究(NCT03439670)的數據,該研究評估了vamorolone對4歲至7歲DMD患兒的療效和安全性。服用vamorolone 6mg/kg/天的治療達到了主要終點(diǎn),在24周時(shí)從基線(xiàn)到站立測試(TTSTAND)速度的變化優(yōu)于安慰劑。此外,在多個(gè)次要終點(diǎn)方面優(yōu)于安慰劑,包括站立速度、6分鐘步行測試及10米跑/走時(shí)間。
12
OMVOH
生產(chǎn)廠(chǎng)家:ELI LILLY AND CO
申請類(lèi)型:新適應癥
2023年10月26日,IL-23p19單抗Mirikizumab(商品名:Omvoh)獲得FDA批準,用于治療成人中至重度潰瘍性結腸炎(UC)。該藥品為首 個(gè)獲批用于治療UC的IL-23抗體。Mirikizumab是一種人源化IgG4單克隆抗體,能夠特異性地與IL-23的p19亞基結合,從而阻斷IL-23介導的炎癥反應而不影響IL-12介導的免疫反應。IL-23是一種參與炎癥過(guò)程的細胞因子,被認為與多種慢性免疫介導的疾病相關(guān)。
FDA的批準是基于兩項隨機雙盲、安慰劑對照的臨床III期試驗。一項是為期12周的誘導治療研究(UC-1),另一項是為期40周的維持治療研究(UC-2)。試驗結果顯示,Omvoh治療12周后,65%的患者獲得臨床應答,24%的患者獲得臨床緩解,而安慰劑組的臨床應答和臨床緩解率分別為43%和15%。在12周達到臨床緩解的患者中,66%的患者在連續治療1年期間維持臨床緩解,而安慰劑組則為40%。安全性方面,與安慰劑組(UC-1為7.2%,UC-2為8.3%)相比,使用Omvoh的患者因不良事件停止治療的可能性較小(UC-1和UC-2分別為1.6%和1.5%)。
13
CABAZITAXEL
生產(chǎn)廠(chǎng)家:SANDOZ
申請類(lèi)型:新制劑
2023年10月27日,FDA批準山德斯公司提交卡巴他賽注射液505 (b)(2)申請,此次獲批基于FDA對上市藥物JEVTANA(卡巴他賽)注射液60mg/1.5mL(NDA#201023;賽諾菲-安萬(wàn)特)的安全性和有效性的調查結果。JEVTANA于2010年6月17日獲批,作為一種兩瓶制劑,用于治療激素難治性轉移性前列腺癌患者。山德士提交的卡巴他賽注射液的活性成分、給藥途徑和劑型與JEVTANA相同。山德士制劑的規格為10mg/mL,有4.5mg/4.5mL小瓶和60mg/6ml小瓶?jì)煞N包裝。給藥前,用0.9%氯化鈉溶液或5%葡萄糖溶液稀釋后輸注。含有一瓶13%乙醇的稀釋劑,給藥前需要進(jìn)行兩步稀釋?zhuān)cJEVTANA不同,山德士產(chǎn)品不需要兩步稀釋。
此外,山德士產(chǎn)品的輔料含量不同,乙醇濃度增加到19.8%,并且含有聚乙二醇300 (PEG 300),而JEVTANA不含PEG。由于該藥品依賴(lài)于Jevtana的安全性和有效性,因此,沒(méi)有提交新的臨床信息。
14
LOQTORZI
生產(chǎn)廠(chǎng)家:COHERUS BIOSCIENCES INC
申請類(lèi)型:新適應癥
2023年10月27日,君實(shí)生物海外合作方Coherus Biosciences宣布,PD-1單抗特瑞普利單抗LOQTORZI? (toripalimab-tpzi) 已獲FDA批準,聯(lián)用順鉑/吉西他濱一線(xiàn)治療晚期復發(fā)或轉移性鼻咽癌(NPC);作為單藥療法,用于鉑類(lèi)化療后進(jìn)展的不可切除或轉移性鼻咽癌(NPC)NPC。這是國產(chǎn)PD-1在美國斬獲的首 個(gè)上市批準,具有里程碑意義。相關(guān)文章傳送門(mén):為什么又是君實(shí)生物取得了突破?
此前,美國地區尚無(wú)其他PD-1單抗獲批鼻咽癌適應癥。此次獲批基于JUPITER-02(一項隨機、雙盲、安慰劑對照、國際多中心III期臨床研究)及POLARIS-02(一項多中心、開(kāi)放標簽、II期關(guān)鍵注冊臨床研究)的研究結果。相較于對照組,特瑞普利單抗+化療顯著(zhù)延長(cháng)mPFS 13.2 個(gè)月,提升了近3倍,疾病進(jìn)展或死亡風(fēng)險降低 48%。3 年OS率較對照組提升了15.3%,死亡風(fēng)險降低37%,具有顯著(zhù)的統計學(xué)差異。








合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57