本報告重點(diǎn)資訊
?2021年共計有83個(gè)ANDA在美國獲得首仿藥批準,部分國內已上市
?2021年FDA批準的新藥中共計有27款first-in-class藥物
?2021年復星醫藥旗下GLAND PHARMA LTD成為中國藥企在FDA上市榜首
?米諾地爾和普瑞巴林為企業(yè)在藥智FDA上市熱門(mén)檢索藥物
?注射劑和片劑為企業(yè)在藥智FDA上市熱門(mén)檢索劑型
2021年FDA批準藥品概述
2021年是極為重要的一年,FDA下屬藥品審評和研究中心(以下稱(chēng)CDER)在2021年批準了許多不同的藥物療法,用以幫助患者減輕疾病,保護患者免受危及生命的疾病侵害。
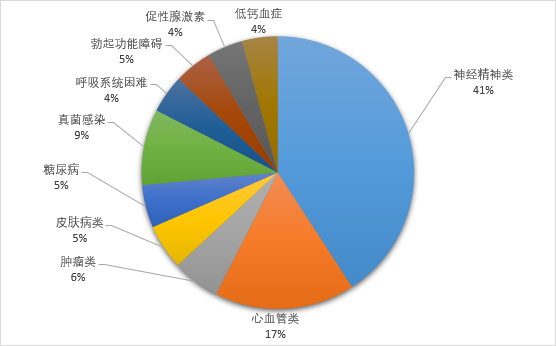
結合藥智美國上市藥品數據庫,2021年FDA批準藥物疾病領(lǐng)域集中體現在心臟、血液、腎 臟、內分泌疾病、自身免疫、炎癥、肺部疾病、傳染性疾病、神經(jīng)和**疾病、癌癥。
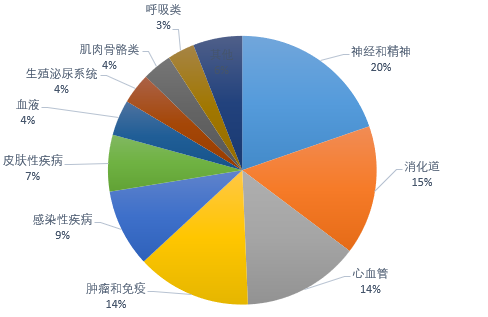
圖一 2021年度FDA批準藥物的疾病領(lǐng)域分布
(來(lái)源:藥智數據美國上市藥品數據庫)
創(chuàng )新藥批準
2021年,CDER批準了NDA 99個(gè),BLA20個(gè),其中新分子實(shí)體藥(NME)即創(chuàng )新藥共計50個(gè)。CDER批準的這些新藥因其潛在的積極影響和對患者的獨特貢獻而備受業(yè)界關(guān)注。
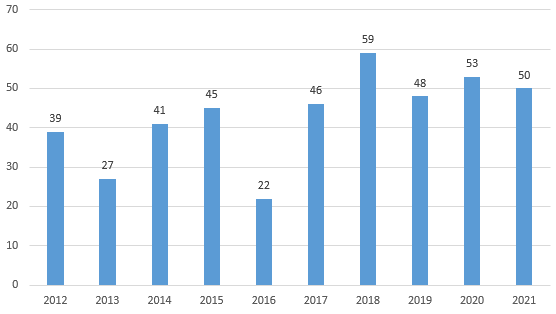
圖二 近10年CDER批準上市的創(chuàng )新藥(來(lái)源:藥智數據美國上市藥品數據庫)
First-in-class
根據藥智美國上市藥品數據庫統計,2021年CDER批準了27款first-in-class首創(chuàng )新藥(54%),以下介紹獲批首創(chuàng )新藥中值得注意的批準案例。
NO.1 ADUHELM (阿度努單抗注射劑)
由BIOGEN INC研發(fā)的ADUHELM于2021年6月7日獲得FDA批準上市。ADUHELM是一種生物藥,主要用于治療阿爾茨海默病,該藥是全球首 個(gè)針對基本疾病病理生理學(xué)的阿爾茨海默病療法。阿爾茨海默病是老年期癡呆最常見(jiàn)的一種類(lèi)型,以進(jìn)行性發(fā)展的神經(jīng)系統變性為特征,是導致老年人失能的重要原因。ADUHELM的上市對阿爾茨海默病的治療起到了積極作用。
NO.2 Brexafemme(艾瑞芬凈片)
20多年來(lái)第一個(gè)獲批的新抗真菌類(lèi)藥物Brexafemme,這是由SCYNEXIS研發(fā)的一種用于治療的外陰陰道念珠菌病,酵母菌感染的藥物。SCYNEXIS是一家總部位于美國新澤西州的生物技術(shù)公司,專(zhuān)注于開(kāi)發(fā)創(chuàng )新療法,用于難治性和常常危及生命的感染性疾病的治療。SCYNEXIS提交的Brexafemme新藥申請于2021年6月1日獲得批準,并且在審評階段就獲得了FDA優(yōu)先審評和快速審批通道的認定。
NO.3 Rybrevant(埃萬(wàn)妥單抗注射劑)
Rybrevant于2021年5月21日獲批,主要用于治療患有某些形式腫瘤具有特定突變的非小細胞肺癌成人患者。值得注意的是:Rybrevant是第一個(gè)獲得FDA批準的針對非小細胞肺癌亞群的治療藥,并通過(guò)快速審批途徑獲得批準。
表一 2021年FDA批準的first-in-class新藥
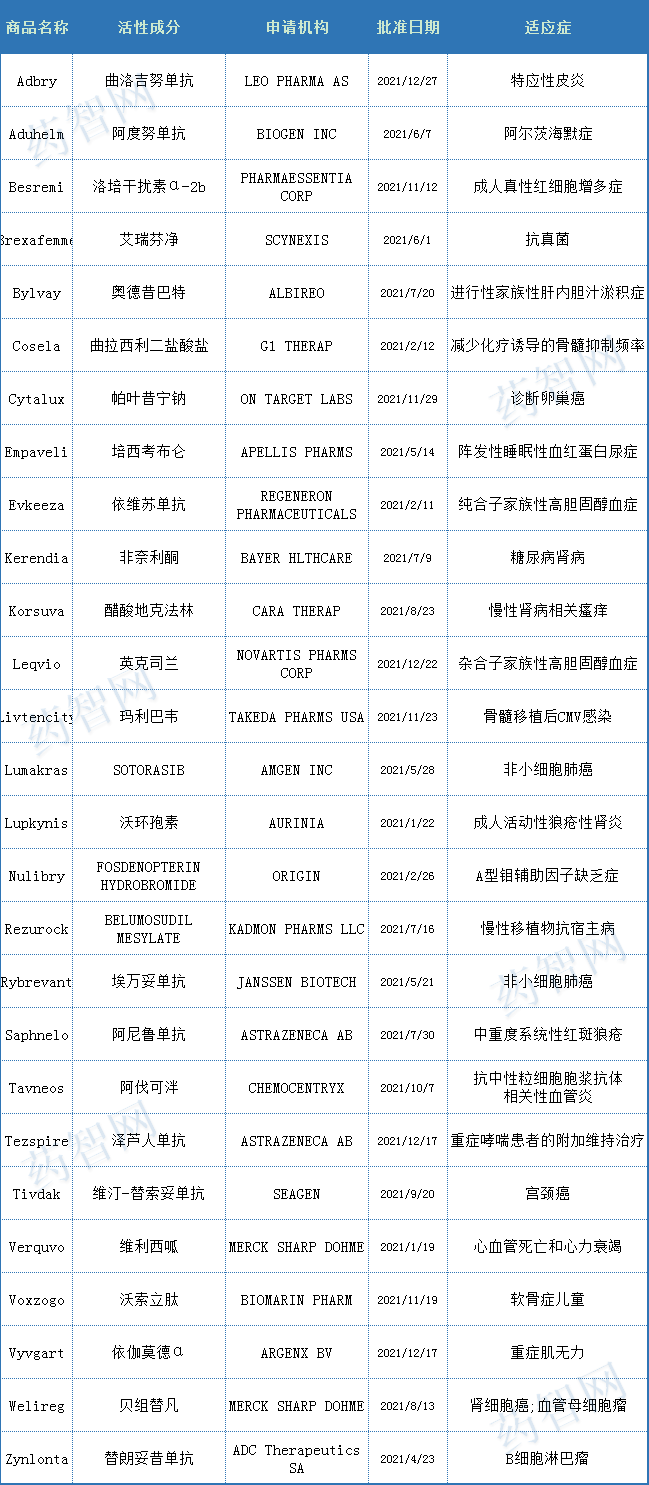
(來(lái)源:藥智數據美國上市藥品數據庫)
首仿藥(First Generics)及國內上市情況
首仿藥即首次仿制藥,FDA首次批準并允許制造商在美國銷(xiāo)售此藥。FDA認為第一個(gè)首仿藥對公眾健康很重要,并優(yōu)先審查這些提交的文件。值得注意的是,FDA允許首仿藥有180天的市場(chǎng)獨占權。2021年超過(guò)80款藥物,被FDA界定為首仿藥。
在本年度批準的首仿藥系列中,上海復星醫藥旗下GLAND PHARMA LTD的鹽酸替羅非班于2021年4月獲得FDA首仿藥上市批準。鹽酸替羅非班主要用于治療急性冠狀動(dòng)脈綜合癥。GLAND PHARMA LTD為中國獨一家獲得了FDA首仿藥的批準企業(yè)。
孤兒藥(Orphan Drugs)
根據藥智美孤兒藥與罕見(jiàn)病數據庫統計,2021年度共計有35款獲得FDA認定且已批準上市,美國FDA允許孤兒藥有7年的市場(chǎng)獨占期。
“孤兒藥”又稱(chēng)為罕見(jiàn)藥,用于預防、治療、診斷罕見(jiàn)病的藥品,由于罕見(jiàn)病患病人群少、市場(chǎng)需求少、研發(fā)成本高,很少有制藥企業(yè)關(guān)注其治療藥物的研發(fā),因此這些藥被形象地稱(chēng)為“孤兒藥”。
FEXINIDAZOLE(非昔硝唑片)
非昔硝唑片是由賽諾菲開(kāi)發(fā)的一種用于治療昏睡病(非洲人類(lèi)錐蟲(chóng)病),2021年7月16日獲得批準上市。非洲人類(lèi)錐蟲(chóng)病是一種由受感染的寄生蟲(chóng)引起的危及生命的疾病,在許多撒哈拉以南的非洲國家流行。 非西硝唑片是第一個(gè)口服治療昏睡病的藥物。(其他治療包括口服成分與非口服藥物聯(lián)合服用。)
NULIBRY(FOSDENOPTERIN HYDROBROMIDE)
Nulibry 通過(guò)靜脈注射給藥方式可降低由A型鉬輔助因子缺乏癥(遺傳性疾病)死亡風(fēng)險,通常出現在生命的最初幾天,導致難以控制的癲癇發(fā)作、腦損傷和死亡。Nulibry是第一個(gè)獲批的用于治療這種疾病的方法,于2021年2月26日獲得FDA上市批準。
美國首批
美國首批即在其他國家批準之前在美國首次批準的藥物。2021年,約42款新藥為美國首次批準。Pradaxa(甲磺酸達比加群酯膠囊)最早在2010年10月獲批,主要用于預防心房顫動(dòng)、深靜脈血栓形成、肺栓塞中的血栓栓塞。2021 年,CDER 擴大了Pradaxa的用途,以預防和治療某些年僅8歲左右兒童患者的血栓。Pradaxa是FDA批準的第一個(gè)用于兒童類(lèi)的口服血液稀釋藥物。
中國藥企
2021年度,中國藥企繼續保持在FDA獲批上市的良好態(tài)勢,其中復星醫藥旗下的GLAND PHARMA LTD通過(guò)了14個(gè)ANDA的上市批準,取得中國藥企在FDA獲批數量的第一名。GLAND PHARMA LTD位于印度海德拉巴,是一家國際化并擁有原研藥及制劑研發(fā)生產(chǎn)能力成熟規范的仿制藥注射劑龍頭企業(yè),產(chǎn)品主要售向美國,2017年9月被復星醫藥收購。
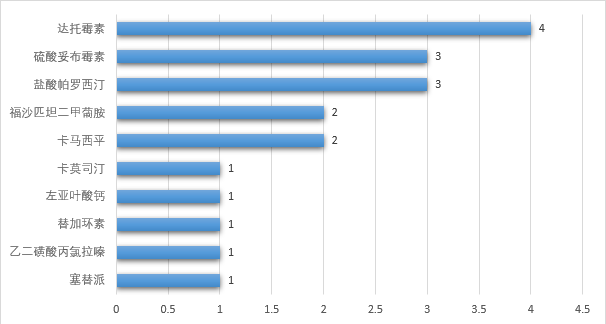
圖三 2021年度中國藥企主要在FDA上市的品種排行(前十)
(來(lái)源:藥智數據美國上市藥品數據庫)
除復星醫藥之外,南京健友、景峰醫藥、浙江華海等企業(yè)也不甘落后,陸續有多款藥物在FDA上市。2021年中國藥企在FDA上市的藥品劑型中,數量最多的仍然是注射劑,其次片劑。
熱門(mén)檢索:米諾地爾和普瑞巴林
根據藥智企業(yè)版數據分析系統:米諾地爾和普瑞巴林成為2021年企業(yè)版用戶(hù)在檢索美國FDA上市藥品數據庫中最熱門(mén)的藥物。可見(jiàn),高血壓和神經(jīng)**類(lèi)疾病領(lǐng)域是國內制藥企業(yè)關(guān)注的熱點(diǎn),2021年度有超過(guò)20家國內企業(yè)在上述領(lǐng)域進(jìn)行仿制藥生產(chǎn)研究。
微信圖片_20220119082937.png
圖四 2021年國內制藥企業(yè)重點(diǎn)關(guān)注的疾病領(lǐng)域(列舉前十)(來(lái)源:藥智數據美國上市藥品數據庫)
<米諾地爾>
米諾地爾最早是由法瑪西亞普強公司(輝瑞子公司)開(kāi)發(fā)用于治療潰瘍,但動(dòng)物實(shí)驗中發(fā)現潰瘍并未被治愈,卻被證明是一個(gè)強大的血管舒張劑,通過(guò)直接引起外周動(dòng)脈血管舒張來(lái)治療高血壓。1979年,FDA首次批準米諾地爾(商品名Loniten)口服片劑用于治療高血壓。與此同時(shí),米諾地爾還可以用來(lái)治療脫發(fā),并且在臨床上也在廣泛應用。
表二 2021年度FDA批準對含米諾地爾的藥物(按照申請機構瀏覽)
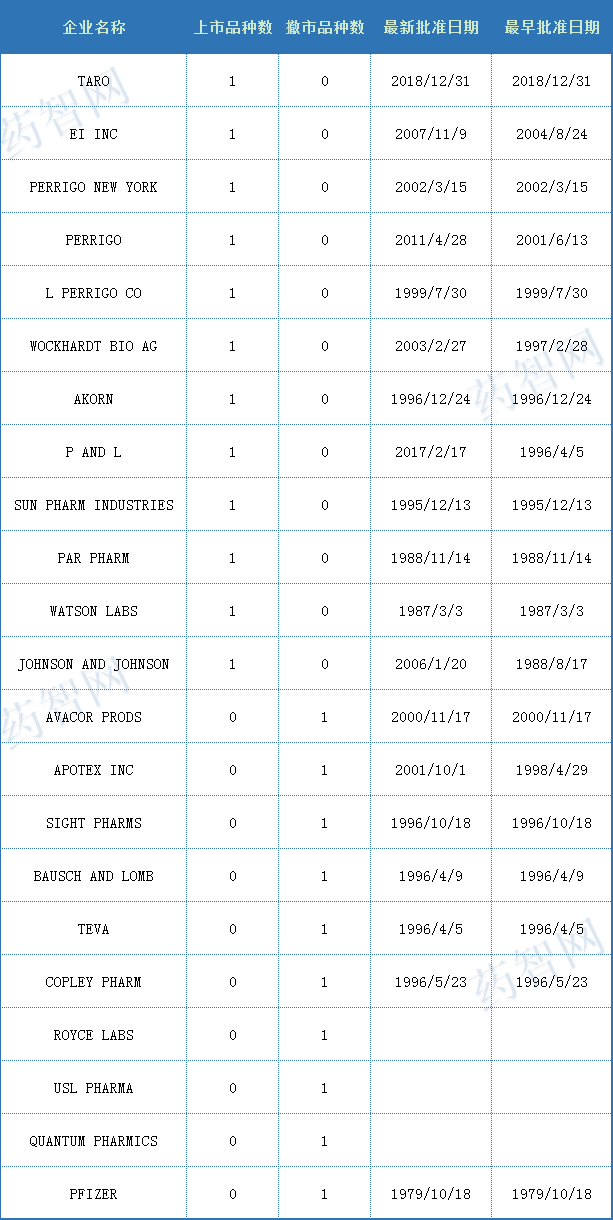
(來(lái)源:藥智數據美國上市藥品數據庫)
<普瑞巴林>
普瑞巴林是由輝瑞研發(fā)的一種新型的γ-氨基丁酸(GABA)受體激動(dòng)劑,用于治療糖尿病性外周神經(jīng)病變(DPN)或脊髓損傷導致的神經(jīng)疼痛,帶狀皰疹后遺神經(jīng)痛(PHN)、纖維肌痛和癲癇發(fā)作。普瑞巴林最早于2004年7月6日獲EMA批準上市,商品名為L(cháng)yrica,FDA在2004年12月30日批準上市, 2010年4月16日獲日本PMDA批準上市。
表三 2021年度FDA批準含普瑞巴林的藥物(按照申請機構瀏覽)
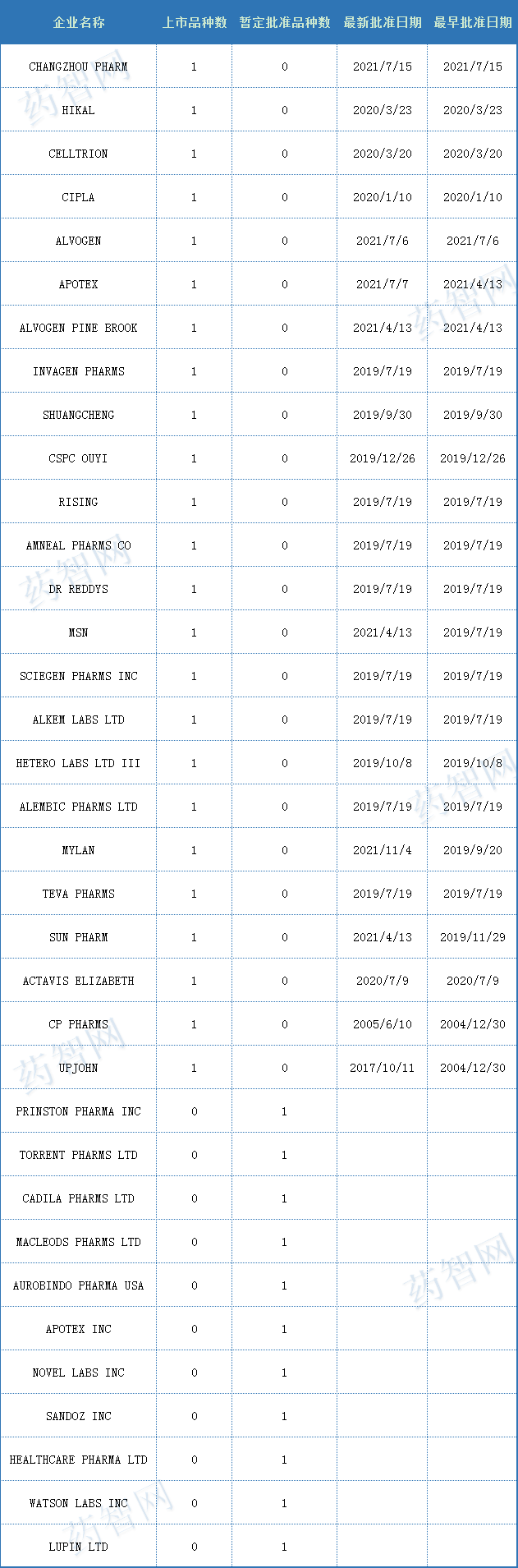
(來(lái)源:藥智數據美國上市藥品數據庫)
數據來(lái)源:藥智數據美國上市藥品數據庫、藥智孤兒藥與罕見(jiàn)病數據庫、 Drugs@FDA








合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57