近日,國家藥品監督管理局藥品審評中心(CDE)發(fā)布《中國新藥注冊臨床試驗現狀年度報告(2020年)》(以下簡(jiǎn)稱(chēng)《報告》),這是首 次對中國新藥注冊臨床試驗現狀進(jìn)行全面匯總分析的一份報告。
這份帶著(zhù)“熱氣”的報告背后,一些問(wèn)題也引發(fā)了業(yè)內的冷思考。
同質(zhì)化“內卷”,資源浪費不容小覷
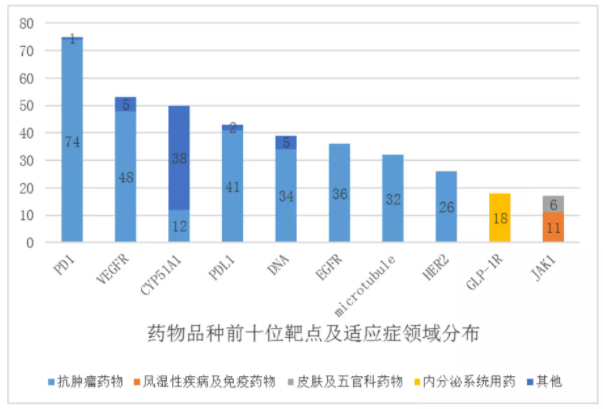
該《報告》數據顯示,2020年藥物臨床試驗登記與信息公示平臺共登記臨床試驗2602項,但登記臨床的藥物品種的前10位靶點(diǎn)為PD-1、CYP51A1、VEGFR、PD-L1、DNA、EGFR、microrubule、HER2、GLP-1R、JAK1,總品種數量多達389項,占比超10%。
從臨床試驗數量看,上述TOP10靶點(diǎn)的臨床數量也很集中,其中PD-1、VEGFR、PD-L1等靶點(diǎn)的品種開(kāi)展的臨床試驗均超過(guò)60多項,PD-1靶點(diǎn)的臨床試驗的數量將近100項。
另外,從適應癥看,臨床試驗主要集中在抗腫瘤和抗感染等領(lǐng)域,生物藥和化藥臨床試驗適應癥都以抗腫瘤為主,分別42.1%和47.3%。
不難看出,新藥臨床試驗同質(zhì)化“內卷”嚴重。國內臨床資源在腫瘤、熱門(mén)靶點(diǎn)上競爭激烈。
但此前有業(yè)內人士分析,“同質(zhì)化”現象會(huì )對臨床資源造成一些浪費。就拿PD-1來(lái)說(shuō),目前全國已上市6款產(chǎn)品,并且在適應癥探索、商業(yè)化策略上打的火熱。在最新一輪的醫保談判中,網(wǎng)傳版的PD-1的價(jià)格儼然已控制在3~4萬(wàn)元一年。但目前仍有100余項臨床試驗正在進(jìn)行中,這樣“同質(zhì)化”的研發(fā)也如同雞肋一般,食之無(wú)味,棄之可惜。
從這里也不難看出疾病選擇和靶點(diǎn)立項,就像是選擇賽道。選對了疾病和靶點(diǎn),研發(fā)做的快慢,可能只是價(jià)值的大小,如果選錯了靶點(diǎn),所有的付出都付之東流。

圖片來(lái)源:CDE2020年中國新藥臨床試驗報告
圖片來(lái)源:CDE2020年中國新藥臨床試驗報告
同時(shí),《報告》中還有一個(gè)數據值得關(guān)注:“關(guān)于試驗范圍,僅在國內開(kāi)展臨床試驗的藥物高達91.6%。”也即是說(shuō),國際多中心試驗僅占8.1%(210項)。相比資本熱上空喊“中美雙報”、“全球臨床”的企業(yè)數量相比,真正將自己的產(chǎn)品放在全球競爭的賽道上的臨床數量略顯捉襟見(jiàn)肘。
其次,臨床推進(jìn)的效率令人擔憂(yōu)。《報告》數據顯示,2020年登記的創(chuàng )新藥臨床試驗1473項,IND獲批后一年內啟動(dòng)受試者招募的比例不足一半(45.4%)。2020年完成的臨床試驗中仍以I期臨床試驗為主,平均完成時(shí)間為95.7天;完成的III期臨床試驗僅為5項,平均完成時(shí)間為176.6天。不難看出,目前國內超一半的新藥在獲得IND批件后超過(guò)1年才啟動(dòng)新藥臨床試驗,但也幾乎會(huì )在3年內都會(huì )進(jìn)入到I期臨床的階段。
第三,兒科藥物臨床試驗占比較低。在1473項臨床試驗中,含兒童受試者的臨床試驗為129項,占比為8.8%。僅在兒童人群中開(kāi)展的新藥臨床試驗共登記33項,僅占新藥臨床試驗總體的2.2%,而適應癥主要為抗腫瘤藥物和**。研發(fā)積極性不高的原因則在于,兒科藥物臨床試驗存在周期長(cháng)、受試者招募困難、安全性風(fēng)險高等因素有關(guān)。
第四,臨床試驗地域分布不均勻。我國臨床試驗機構資質(zhì)從認證制改為備案制后,雖然鼓勵更多醫療機構參與臨床試驗,但臨床試驗地域分布仍然不夠均衡。國內新藥臨床試驗中仍然是北京市、江蘇省和上海市的機構參加臨床試驗次數較多。
差異化競爭或成破局關(guān)鍵
外行看熱鬧,內行看門(mén)道。在數據的背后,我們已然看到,國內新藥研發(fā)與國外的臨床實(shí)踐差距正在進(jìn)一步地縮小,但是靶點(diǎn)扎堆、適應癥集中,“過(guò)剩”和“緊缺”等問(wèn)題仍存在。從臨床研發(fā)和評價(jià)的角度來(lái)講,以臨床價(jià)值為導向的創(chuàng )新和研發(fā)始終是一個(gè)核心問(wèn)題,簡(jiǎn)單來(lái)講就是“有需要才有必要”,這是值得全行業(yè)關(guān)注的價(jià)值核心,也是現下企業(yè)差異化競爭破局的關(guān)鍵。
其實(shí)“藥物研發(fā)應以患者需求為核心,以臨床價(jià)值為導向”早已在政策法規上成為普遍共識。此前,國發(fā)【2015】44號文《國務(wù)院關(guān)于改革藥品醫療器械審評審批制度的意見(jiàn)》中指出,“鼓勵以臨床價(jià)值為導向的藥物創(chuàng )新”。ICH在2020年11月通過(guò)了以患者為核心的藥物研發(fā)(PFDD)議題文件。今年7月,國家藥品監督管理局藥品審評中心(CDE)發(fā)布“關(guān)于公開(kāi)征求《以臨床價(jià)值為導向的抗腫瘤藥物臨床研發(fā)指導原則》意見(jiàn)的通知”,明確指出新藥研發(fā)應以為患者提供更優(yōu)的治療選擇為最高目標。意見(jiàn)稿的出臺也意味著(zhù)從抗腫瘤藥研發(fā)開(kāi)始,歷年國家監管推行的以臨床價(jià)值為導向的藥品研發(fā),將影響到全行業(yè)全疾病領(lǐng)域,這個(gè)意義將是深遠的。
就在不久前舉辦的第六屆中國醫藥創(chuàng )新與投資大會(huì )(CBIIC)上,國家藥品監督管理局藥品審評中心化藥臨床一部部長(cháng)楊志敏也表示:“無(wú)論是審評審批,還是藥物研發(fā),都應把目光由藥轉向人。PD-1已經(jīng)臨床批準了100多家,并沒(méi)說(shuō)未來(lái)就不再批準PD-1新藥了。如果我們的關(guān)注點(diǎn)放在藥品上,肯定是在比有多少款藥品已經(jīng)上市。我們比人,也就是關(guān)注治療適應證。如果此適應證無(wú)藥可治,沒(méi)有人做,這時(shí)申報了一款新的PD-1能夠治療它,為什么不批呢?”
目前,已有相當一部分頭部創(chuàng )新藥企開(kāi)始以“臨床價(jià)值”為導向布局研發(fā)管線(xiàn),例如康寧杰瑞即將上市的全球首 款皮下注射PD-L1抑制劑KN035(恩沃利單抗),已在劑型上優(yōu)化給藥方式,幫助病患減輕治療痛苦。
搶占臨床研發(fā)領(lǐng)跑地位
針對臨床效率不高的問(wèn)題,其實(shí)一直是醫藥行業(yè)的“心病”。10年時(shí)間,10億元投入,10%成功率常常被用來(lái)形容一款新藥上市的困難度。對此,泰格醫藥聯(lián)合創(chuàng )始人、董事長(cháng)葉小平博士表示,作為新藥研發(fā)的過(guò)程中的重要環(huán)節,臨床試驗是一個(gè)高度復雜的過(guò)程,在我國創(chuàng )新藥產(chǎn)業(yè)蓬勃發(fā)展的當下,要保證試驗質(zhì)量,同時(shí)提升效率,數字化是其中最有力的手段之一。
另外,浙商醫藥研報表示,在臨床效率不高的現狀下,持續看好臨床CRO市場(chǎng)成長(cháng)性。伴隨著(zhù)臨床試驗機構資質(zhì)從認證制變成備案制之后,預計會(huì )有越來(lái)越多的臨床試驗機構參與到臨床試驗中,臨床CRO市場(chǎng)也有望呈現更為多元化發(fā)展。
兒童用藥或成新風(fēng)口
剛剛結束的第七次人口普查顯示,我國0-14歲兒童約2.53億人,占總人口17.95%,與之前2010年第六次全國人口普查相比比重上升1.35個(gè)百分點(diǎn)。隨著(zhù)“二胎”“三孩”等生育政策的放開(kāi),兒童人口比重回升,兒童人口數量持續增加,兒童用藥的需求也將隨之增長(cháng)。
持續增長(cháng)的市場(chǎng)規模加上接連不斷的政策利好,兒童藥行業(yè)將迎來(lái)新的發(fā)展機遇,風(fēng)口仿佛近在眼前。但現實(shí)是,截止2019年9月,在我國6000多家藥廠(chǎng)中,有兒童藥品生產(chǎn)部門(mén)的企業(yè)約30家,專(zhuān)門(mén)生產(chǎn)兒童藥品的企業(yè)更是僅有10余家,而截止目前已不足10家。另?yè)y計,我國兒童藥品種占藥物總量的比例不足10%,而且其中90%以上并非兒童專(zhuān)用藥。臨床缺少兒童專(zhuān)用藥的情況下,兒童常常被當作成人的縮小版把成人藥減量使用,存在著(zhù)巨大的安全隱患。
對企業(yè)來(lái)說(shuō),現實(shí)的落差里未被滿(mǎn)足的需求正是機遇。2021年,兒童藥審評速度明顯加快,截至目前已有14個(gè)兒童用藥獲批上市。其中,百濟神州引進(jìn)的新藥達妥昔單抗β(Dinutuximabbeta,迪妥昔單抗)獲國家藥監局批準上市,用于神經(jīng)母細胞瘤的治療,可以為更多兒童高危神經(jīng)母細胞瘤患者帶來(lái)新的治療選擇。
結語(yǔ)
危機即轉機,挑戰即機遇。此次公布的2020年新藥臨床試驗現狀年度報告,也再次印證了中國生物醫藥產(chǎn)業(yè)開(kāi)始從熱潮走向冷靜,從資本追逐走向以人為本。或許在這一數據事實(shí)之下,會(huì )帶給從業(yè)者新的思考與考量,讓本土生物醫藥產(chǎn)業(yè)往更健康的發(fā)展生態(tài)模式走去……
責任編輯:三七








合作咨詢(xún)
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57